Le potentiel Hydrogène

Théorie
le potentiel hydrogène noté pH mesure l’acidité ou la basicité d’une solution.
- une solution de pH < 7 est dite acide ; plus son pH s'éloigne de 7 (diminue) et plus elle est acide ;
- une solution de pH = 7 est dite neutre ;
- une solution de pH > 7 est dite basique ; plus son pH s'éloigne de 7 (augmente) et plus elle est basique.
Vous retrouverez sur le schéma ci-dessous quelques exemple de pH de substances qui nous entourent au quotidien.
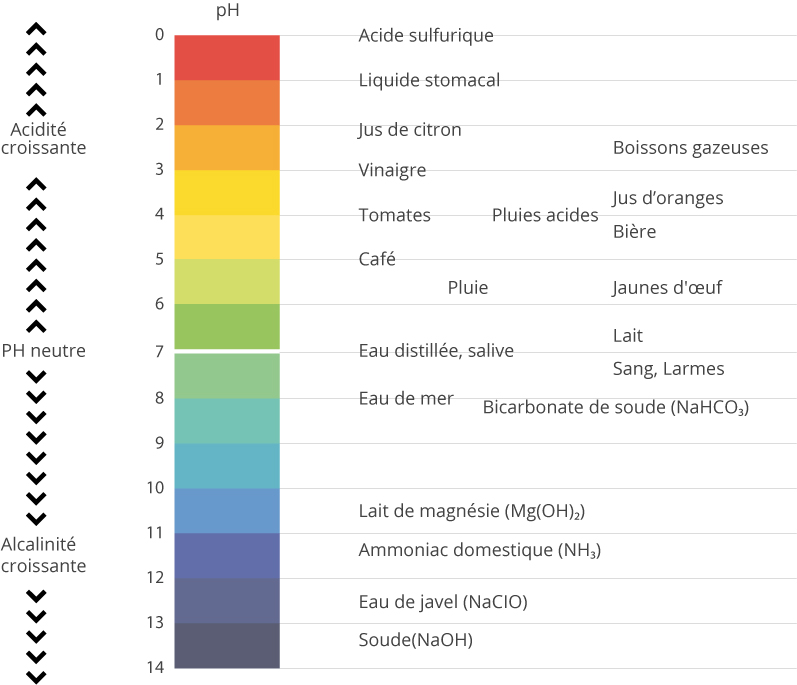
En solution aqueuse, à température et pression standard, un pH de 7,0 indique la neutralité car l’eau, amphotère, se dissocie naturellement en ions H+ et HO- aux concentrations de 1,0×10-7 mol.L-1 (mol=mole). Cette dissociation est appelée autoprotolyse de l’eau :
- l’eau est un acide : H2O (l) = H+ (aq) + HO- (aq)
- l’eau est une base : H2O (l) + H+ (aq) = H3O+ (aq)
- d’où la réaction : H2O (l) + H2O (l) = H3O+ (aq) + HO- (aq)
Cette dernière réaction explique la formation des ions oxonium (H3O+) et hydroxyde (OH-) dans l’eau pure et permet de relier leurs concentrations par une équation vraie pour toute solution aqueuse :
Ke=[H3O+].[HO-] = 10-14
Ke est appelé produit ionique de l’eau, il est sans unité et toujours égal à 10-14 à 25 °C.
La concentration en ions oxonium est directement liée à la valeur du pH. Pour un milieu donné, on peut toujours écrire que:
[H3O+] = 10-pH ou pH = - log [H3O+]
Un milieu acide aura donc une forte concentration en ions oxonium H3O+, équivalente à une faible valeur de pH. L'inverse est vrai pour un environnement basique.
Calcul du pH de l'eau pure
On a vu que dans une eau pure les ions hydroxyde et oxonium sont produits en quantité égale par autoprotolyse, leurs concentrations sont identiques: [H3O+]= [OH-]
L'expression du produit ionique de l'eau (Ke=[H3O+].[HO-] = 10-14) peut donc s'écrire:
Ke = [H3O+] x [OH-]
Ke = [H3O+] x [H3O+]
Ke = [H3O+]2
10-14 = [H3O+]2
[H3O+] = 10-7 ([H3O+] = 10-pH)
Donc pH = 7 ce qui correspond bien au pH d'une solution neutre. La concentration des ions oxonium et hydroxyde est de 10-7 mol.L-1 .
Remarque: Le Ka
Dans le cas des acides faibles, on définit une constante d’équilibre de dissociation de l’acide ou constante d’acidité.

Elle est notée Ka et s’écrit :
Ka = [A-][H+]/[AH]
A partir du Ka on définit le pKa qui s’écrit pKa = - log Ka
On utilise généralement le Pka plutôt que le Ka pour déterminer la force d’un acide.
Plus l’acide est fort plus le pKa a est petit.
La relation devient alors :
-log [Ka] = - log [H+] – log[A-]/[AH] → pKa = pH - log[A-]/[AH]
d’où la définition du pH en fonction du pKa :
pH = pKa + log[A-]/[AH]
La pratique: Mesure du Ph
Comme nous l'avons vu dans l'article concernant les différents milieux de culture, la valeur du pH est une donnée fondamentale en culture in vitro.
Pour mesurer sa valeur, on va utiliser un pH-mètre qui n'est rien d'autre qu'un voltmètre mesurant la tension aux bornes de l'électrode à laquelle il est relié.

Cette tension est une fonction affine telle que: pH = a.x+b
Pour que le pH-mètre indique le pH et non la tension, il faut relier ces 2 grandeurs grâce aux 2 constantes a et b.
Cette dernière opération est réalisée expérimentalement en trempant l'électrode dans 2 solutions tampon de pH connu.

Les solutions tampon sont des solutions dont le pH varie peu lorsque l’on ajoute de faibles quantités d’acides ou de bases. Elles peuvent être fabriquées en utilisant un mélange équimolaire d’un acide faible et de sa base conjuguée (recettes de solution tampon) mais le plus simple est de les acheter! (dans les growshop à moins de 4€ les 250ml).
Lorsque l'étalonnage est fait, il ne reste plus qu'à mesurer le Ph de la solution et de rectifier si nécessaire à l'aide d'acide chlorhydrique ou de soude.

Vous retrouverez des exemples complets dans les articles concernants les milieux de culture de base ici.
pH des milieux de culture en poudre du commerce
Si vous préparez vos milieux de culture à l'aide de poudre du commerce, vous n'aurez pas à vous préoccuper du pH. En effet, ces mélanges contiennent une molécule capable de maintenir le pH entre deux valeurs fixes.
On appelle cette molécule "hermaphrodite" (zwitter en allemand) un zwitterion ou amphion. Sa structure chimique lui permet de capter ou de céder des protons (H+) selon la valeur du pH de la solution aqueuse où elle se trouve.
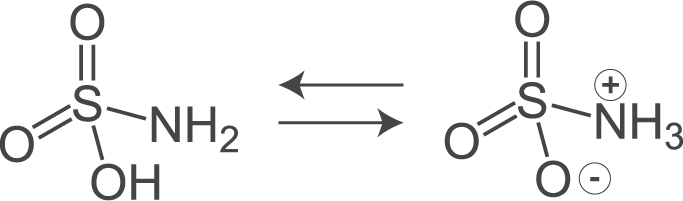
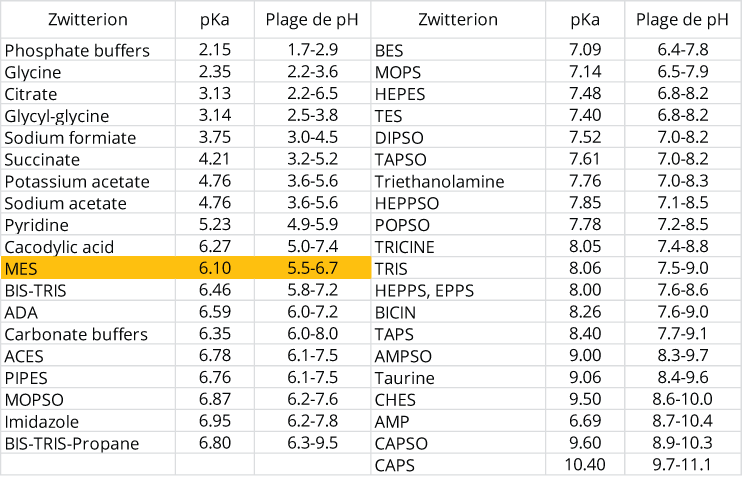
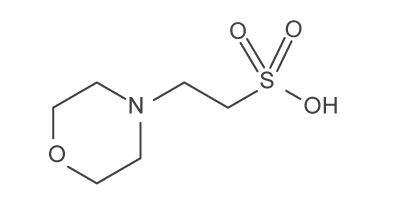
En fonction de la plage de pH que l'on veut, on va utiliser différentes molécules (voir tableau ci-dessous). Pour les valeurs de pH de nos milieux de culture, les industriels utilisent du MES ou acide 2-(morpholin-4-yl)éthanesulfonique ( C6H13NO4S ).
Glossaire
amphotère
Une espèce chimique est dite amphotère quand elle se comporter à la fois comme un acide et une base.
MES
mole
La mole est une unité qui mesure un nombre d'objets extrêmement petits et nombreux, comme les molécules, les atomes, les électrons, les photons...
Un échantillon de matière de taille macroscopique contient un très grand nombre d'atomes.
Par exemple, 6 grammes d'aluminium contiennent environ 1,34×1023 atomes (134 000 000 000 000 000 000 000 atomes ; soit 134 000 milliards de milliards).
Pour éviter l'utilisation d'aussi grands nombres, on a créé une unité de mesure, la mole (dans le cas présent, 6 grammes d'aluminium représentent 0,22 mole d'atomes).
Une mole d’atomes contient environ 6,02214040×1023 atomes.
Ce nombre est appelé nombre d'Avogadro. Il est constant quel que soit l'élément quantifié. Autrement dit, de la même manière qu'il y a autant d'éléments dans une douzaine de pommes que dans une douzaine d'œufs, il y a le même nombre d'atomes dans une mole de carbone que dans une mole de plomb (soit 602 214 milliards de milliards d'atomes).
recettes de solution tampon
pH = 1
Mélanger 25 mL de KCl à 0,2 mol/L + 54,2 mL d’HCl à 0,2 mol/L. Compléter à 100 mL avec de l’eau.
pH = 2
Mélanger 25 mL de KCl à 0,2 mol/L + 5,9 mL d’HCl à 0,2 mol/L. Compléter à 100 mL avec de l’eau.
pH = 3
Mélanger 50 mL d’hydrogénophtalate de potassium à 0,1 mol/L + 22.3 mL d’HCl à 0,1 mol/L. Compléter à 100 mL avec de l’eau.
pH = 4
Préparer 50 mL d’hydrogénophtalate de potassium à 0,1 mol/L. Compléter à 100 mL avec de l’eau.
pH = 5
Mélanger 50 mL d’hydrogénophtalate de potassium à 0,1 mol/L + 22.6 mL de NaOH à 0,1 mol/L. Compléter à 100 mL avec de l’eau.
pH = 6
Mélanger 50 mL d’hydrogénophtalate de potassium à 0,1 mol/L + 45 mL de NaOH à 0,1 mol/L. Compléter à 100 mL avec de l’eau.
pH = 7
Mélanger 50 mL dihydrogénophosphate de potassium (KH2PO4) à 0,1 mol/L + 29,1 mL d’e NaOH à 0,1 mol/L. Compléter à 100 mL avec de l’eau.
pH = 8
Mélanger 50 mL dihydrogénophosphate de potassium (KH2PO4) à 0,1 mol/L + 46.7 mL d’e NaOH à 0,1 mol/L. Compléter à 100 mL avec de l’eau.
pH = 9
Mélanger 50 mL de borax à 0,025 mol/L + 4,6 mL d’ HCl à 0,1 mol/L. Compléter à 100 mL avec de l’eau.
pH= 10
Mélanger 50 mL de borax à 0,025 mol/L + 18,3 mL de NaOH à 0,1 mol/L. Compléter à 100 mL avec de l’eau.
pH = 11
Mélanger 50 mL de di-sodium hydrogéno phosphate à 0,05 mol/L + 4,1 mL de NaOH à 0,1 mol/L. Compléter à 100 mL avec de l’eau.
pH = 12
Mélanger 50 mL de di-sodium hydrogéno phosphate à 0,05 mol/L + 26,9 mL de NaOH à 0,1 mol/L. Compléter à 100 mL avec de l’eau.
